Tidigt på morgonen den 29 december publicerade NEJM en ny klinisk fas III-studie online av det nya kinesiska coronaviruset VV116. Resultaten visade att VV116 inte var sämre än Paxlovid (nematovir/ritonavir) vad gäller klinisk återhämtningstid och hade färre biverkningar.
Bildkälla: NEJM
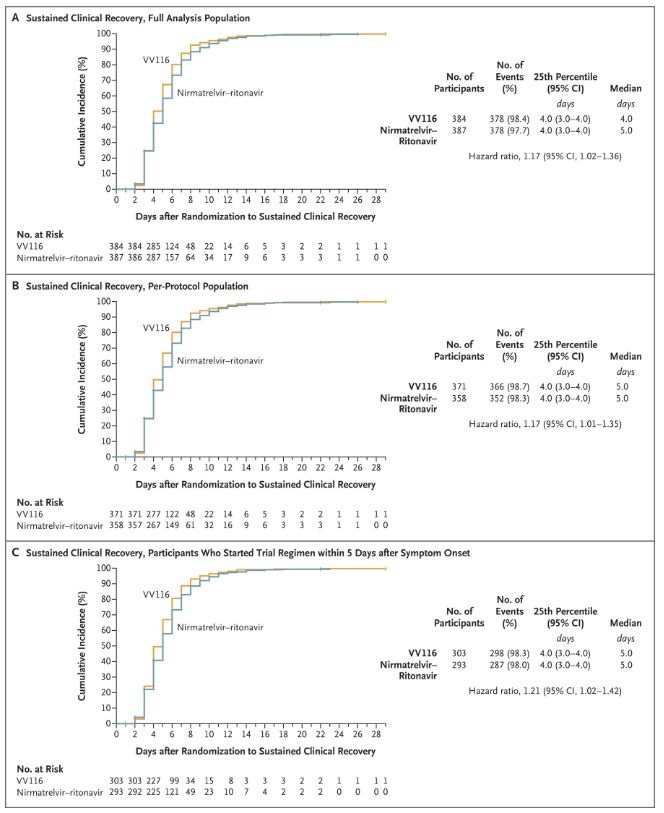
Median återhämtningstid 4 dagar, biverkningsfrekvens 67,4 %
VV116 är ett oralt nukleosidläkemedel mot det nya coronaviruset (SARS-CoV-2) som utvecklats i samarbete med Junsit och Wang Shan Wang Shui, och är en RdRp-hämmare tillsammans med Gileads remdesivir, Merck Sharp & Dohmes molnupiravir och Real Biologics azelvudin.
År 2021 slutfördes en klinisk fas II-studie av VV116 i Uzbekistan. Studiens resultat visade att VV116-gruppen bättre kunde förbättra kliniska symtom och signifikant minska risken för progression till den kritiska formen och död jämfört med kontrollgruppen. Baserat på de positiva resultaten från denna studie har VV116 godkänts i Uzbekistan för behandling av patienter med måttlig till svår COVID-19, och har blivit det första nya orala kranskärlsläkemedlet som godkänts för marknadsföring utomlands i Kina [1].
Denna kliniska fas III-studie[2] (NCT05341609), ledd av professor Zhao Ren från Shanghai Ruijin Hospital, professor Gaoyuan från Shanghai Renji Hospital och akademiker Ning Guang från Shanghai Ruijin Hospital, slutfördes under utbrottet orsakat av Omicron-varianten (B.1.1.529) från mars till maj i Shanghai, med syftet att utvärdera effekten och säkerheten hos VV116 jämfört med Paxlovid för tidig behandling av patienter med mild till måttlig COVID-19. Syftet var att utvärdera effekten och säkerheten hos VV116 jämfört med Paxlovid för tidig behandling av patienter med mild till måttlig COVID-19.
Bildkälla: Referens 2
En multicenter, observatörsblindad, randomiserad, kontrollerad studie med 822 vuxna covid-19-patienter med hög risk för progression och med milda till måttliga symtom genomfördes mellan 4 april och 2 maj 2022 för att bedöma lämpligheten hos deltagare från sju sjukhus i Shanghai, Kina. Slutligen fick 771 deltagare antingen VV116 (384 mg, 600 mg var 12:e timme på dag 1 och 300 mg var 12:e timme på dag 2-5) eller Paxovid (387 mg, 300 mg nimatuvir + 100 mg ritonavir var 12:e timme i 5 dagar) som oral medicinering.
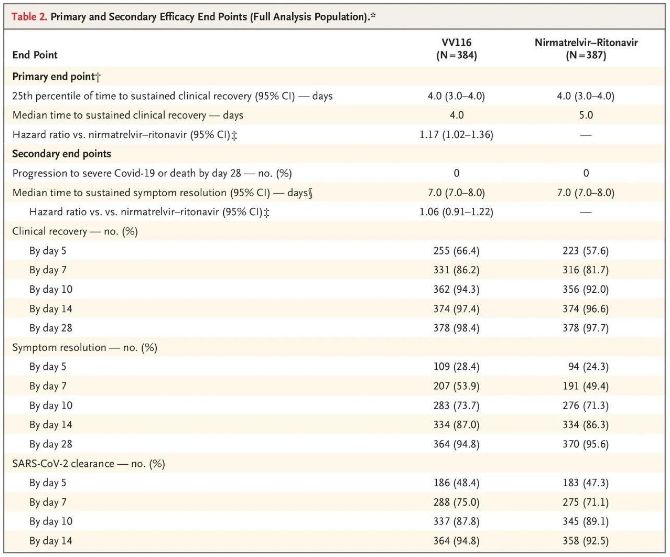
Resultaten av denna kliniska studie visade att tidig behandling med VV116 för mild till måttlig COVID-19 uppnådde det primära effektmåttet (tid till varaktig klinisk återhämtning) som förutspåddes av det kliniska protokollet: mediantiden till klinisk återhämtning var 4 dagar i VV116-gruppen och 5 dagar i Paxlovid-gruppen (riskkvot, 1,17; 95 % KI, 1,02 till 1,36; nedre gräns >0,8).
Bibehålla klinisk återhämtningstid
Primära och sekundära effektmått (omfattande populationsanalys)
Bildkälla: Referens 2
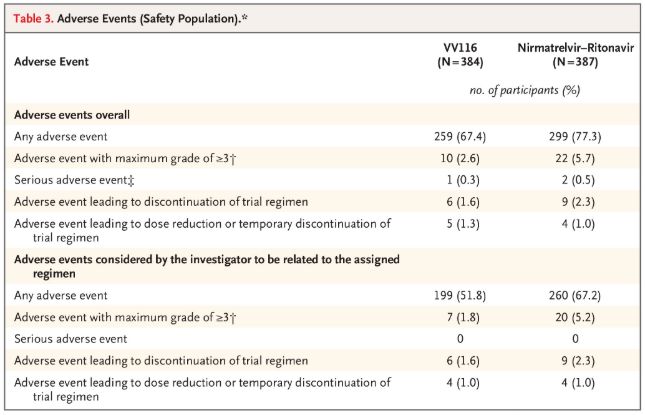
När det gäller säkerhet rapporterade deltagarna som fick VV116 färre biverkningar (67,4 %) än de som fick Paxlovid (77,3 %) vid 28-dagarsuppföljningen, och incidensen av biverkningar av grad 3/4 var lägre för VV116 (2,6 %) än för Paxlovid (5,7 %).
Negativa händelser (säkra personer)
Bildkälla: Referens 2
Kontroverser och frågor
Den 23 maj 2022 offentliggjorde Juniper att den kliniska fas III-registreringsstudien av VV116 jämfört med PAXLOVID för tidig behandling av mild till måttlig COVID-19 (NCT05341609) uppnådde sitt primära effektmått.
Bildkälla: Referens 1
Vid en tidpunkt då detaljer om studien saknades var kontroversen kring fas III-studien tvåfaldig: för det första var det en enkelblind studie och i avsaknad av placebokontroll befarades det att det skulle vara svårt att bedöma läkemedlet helt objektivt; för det andra fanns det frågor om de kliniska effektmåtten.
De kliniska inklusionskriterierna för Juniper är (i) positiva resultat för det nya krontestet, (ii) ett eller flera milda eller måttliga COVID-19-symtom, och (iii) patienter med hög risk för allvarlig COVID-19, inklusive dödsfall. Det enda primära kliniska effektmåttet är dock "tid till varaktig klinisk återhämtning".
Strax före tillkännagivandet, den 14 maj, hade Juniper reviderat de kliniska effektmåtten genom att ta bort ett av de kliniska primära effektmåtten, ”andel konverteringar till allvarlig sjukdom eller död” [3].
Bildkälla: Referens 1
Dessa två huvudsakliga tvistepunkter behandlades också specifikt i den publicerade studien.
På grund av det plötsliga utbrottet av Omicron hade produktionen av placebotabletter för Paxlovid inte slutförts före studiens start och därför kunde forskarna inte genomföra denna studie med en dubbelblind, dubbel-mock-design. När det gäller den enkelblinda aspekten av den kliniska prövningen sa Juniper att protokollet genomfördes efter kommunikation med tillsynsmyndigheterna och att den enkelblinda designen innebär att varken forskaren (inklusive utvärderaren av studiens endpoint) eller sponsorn kommer att känna till den specifika terapeutiska läkemedelsallokeringen förrän den slutliga databasen är låst i slutet av studien.
Fram till tidpunkten för den slutliga analysen hade ingen av deltagarna i studien upplevt dödsfall eller progression till en allvarlig Covid-19-händelse, så inga slutsatser kan dras om effekten av VV116 för att förhindra progression till allvarlig eller kritisk Covid-19 eller dödsfall. Data indikerade att den uppskattade mediantiden från randomisering till ihållande regression av Covid-19-relaterade målsymtom var 7 dagar (95 % KI, 7 till 8) i båda grupperna (riskkvot, 1,06; 95 % KI, 0,91 till 1,22) [2]. Det är inte svårt att förklara varför det primära effektmåttet "konverteringsgrad till allvarlig sjukdom eller död", som ursprungligen sattes före studiens slut, togs bort.
Den 18 maj 2022 publicerade tidskriften Emerging Microbes & Infections resultaten av den första kliniska prövningen av VV116 på patienter infekterade med Omicron-varianten [4], en öppen, prospektiv kohortstudie med 136 bekräftade inneliggande patienter.
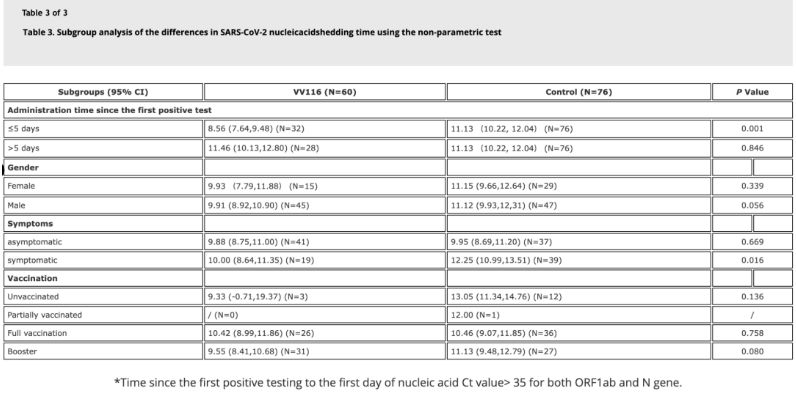
Data från studien visade att patienter med Omicron-infektion som använde VV116 inom 5 dagar efter sitt första positiva nukleinsyratest hade en tid till nukleinsyraregression på 8,56 dagar, vilket är kortare än 11,13 dagar i kontrollgruppen. Administrering av VV116 till symptomatiska patienter inom studiens tidsram (2–10 dagar efter första positiva nukleinsyratest) minskade tiden till nukleinsyraregression hos alla patienter. När det gäller läkemedelssäkerhet observerades inga allvarliga biverkningar i VV116-behandlingsgruppen.
Bildkälla: Referens 4
Det pågår tre kliniska prövningar av VV116, varav två är fas III-studier av mild till måttlig COVID-19 (NCT05242042, NCT05582629). Den andra studien för måttlig till svår COVID-19 är en internationell multicenter, randomiserad, dubbelblind fas III-klinisk studie (NCT05279235) för att utvärdera effekten och säkerheten av VV116 jämfört med standardbehandling. Enligt Junipers tillkännagivande registrerades den första patienten och doserades i mars 2022.
Bildkälla: clinicaltrials.gov
Referenser:
[1]Junshi Biotech: Meddelande om huvudändpunkten för den registrerade kliniska fas III-studien av VV116 jämfört med PAXLOVID för tidig behandling av mild till måttlig COVID-19
[2]https: Yin, Zhiren Fu, Hao Xing, Li Li, Liying Sun, Heyu Huang, Quanbao Zhang, Linlin Xu, Yanting Jin, Rui Chen, Guoyue Lv, Zhijun Zhu, Wenhong Zhang, Zhengxin Wang. (2022) Omicron-infektionsprofil och vaccinationsstatus bland 1881 levertransplantationsmottagare: en multicenter retrospektiv kohort. Emerging Microbes & Infections 11:1, sid 2636-2644.
Publiceringstid: 6 januari 2023
 中文网站
中文网站