Nyligen publicerade JAMA Oncology (IF 33.012) ett viktigt forskningsresultat [1] av teamet bestående av professor Cai Guo-ring från Cancer Hospital vid Fudan University och professor Wang Jing från Renji Hospital vid Shanghai Jiao Tong University School of Medicine, i samarbete med KUNYUAN BIOLOGY: ”Tidig upptäckt av molekylär kvarvarande sjukdom och riskstratifiering för kolorektal cancer i stadium I till III via cirkulerande tumör-DNA-metylering och riskstratifiering)”. Denna studie är den första multicenterstudien i världen som tillämpar PCR-baserad blod-ctDNA-multigenmetyleringsteknik för att förutsäga och övervaka återfall i kolorektal cancer, vilket ger en mer kostnadseffektiv teknisk väg och lösning jämfört med befintliga MRD-detektionsmetoder, vilket förväntas avsevärt förbättra den kliniska användningen av förutsägelse och övervakning av återfall i kolorektal cancer, och avsevärt förbättra patienters överlevnad och livskvalitet. Studien utvärderades också mycket av tidskriften och dess redaktörer, och listades som en viktig rekommendationsartikel i detta nummer, och professor Juan Ruiz-Bañobre från Spanien och professor Ajay Goel från USA inbjöds att granska den. Studien rapporterades också av GenomeWeb, en ledande biomedicinsk medie i USA.

Kolorektal cancer (CRC) är en vanlig malign tumör i mag-tarmkanalen i Kina. Data från International Agency for Research on Cancer (IARC) från 2020 visar att 555 000 nya fall i Kina står för ungefär 1/3 av världens befolkning, med en incidens som stiger till andra plats bland vanliga cancerformer i Kina. 286 000 dödsfall står för ungefär 1/3 av världens befolkning, vilket rankas som den femte vanligaste orsaken till cancerdöd i Kina. Den femte vanligaste dödsorsaken i Kina. Det är anmärkningsvärt att bland de diagnostiserade patienterna är TNM-stadierna I, II, III och IV 18,6 %, 42,5 %, 30,7 % respektive 8,2 %. Mer än 80 % av patienterna befinner sig i mellersta och sena stadier, och 44 % av dem har samtidiga eller heterokroniska fjärrmetastaser till lever och lunga, vilket allvarligt påverkar överlevnadsperioden, äventyrar våra invånares hälsa och orsakar en tung social och ekonomisk börda. Enligt statistik från National Cancer Center är den genomsnittliga årliga ökningen av kostnaden för behandling av kolorektal cancer i Kina cirka 6,9 % till 9,2 %, och patienters personliga hälsokostnader inom ett år efter diagnos kan uppgå till 60 % av familjens inkomst. Cancerpatienter lider av sjukdomen och är också under stor ekonomisk press [2].
Nittio procent av alla lesioner i kolorektal cancer kan avlägsnas kirurgiskt, och ju tidigare tumören upptäcks, desto högre är femårsöverlevnaden efter radikal kirurgisk resektion, men den totala återfallsfrekvensen efter radikal resektion är fortfarande cirka 30 %. Femårsöverlevnaden för kolorektal cancer i den kinesiska befolkningen är 90,1 %, 72,6 %, 53,8 % respektive 10,4 % för stadium I, II, III respektive IV.
Minimal residual disease (MRD) är en viktig orsak till tumöråterfall efter radikal behandling. Under senare år har MRD-detektionstekniken för solida tumörer utvecklats snabbt, och flera tunga observations- och interventionsstudier har bekräftat att postoperativ MRD-status kan indikera risken för postoperativt återfall av kolorektal cancer. ctDNA-testning har fördelarna att vara icke-invasiv, enkel, snabb, med hög provtillgänglighet och att den övervinner tumörheterogenitet.
De amerikanska NCCN-riktlinjerna för tjocktarmscancer och de kinesiska CSCO-riktlinjerna för kolorektal cancer anger båda att ctDNA-testning kan ge prognostisk och prediktiv information för att fastställa postoperativ risk för återfall och välja adjuvant kemoterapi vid tjocktarmscancer, vilket underlättar beslut om adjuvant behandling för patienter med stadium II eller III av tjocktarmscancer. De flesta befintliga studier fokuserar dock på ctDNA-mutationer baserade på högkapacitetssekvenseringsteknik (NGS), som har en komplex process, lång ledtid och hög kostnad [3], med en viss brist på generaliserbarhet och låg prevalens bland cancerpatienter.
För patienter med kolorektal cancer i stadium III kostar dynamisk ctDNA-övervakning med NGS upp till 10 000 dollar för ett enda besök och kräver en väntetid på upp till två veckor. Med multigenmetyleringstestet i denna studie, ColonAiQ®, kan patienter få dynamisk ctDNA-övervakning till en tiondel av kostnaden och få en rapport på så lite som två dagar.
Enligt de 560 000 nya fallen av kolorektal cancer i Kina varje år har kliniska patienter, främst med stadium II-III kolorektal cancer (andelen är cirka 70 %), ett mer brådskande behov av dynamisk övervakning, än vad marknadsstorleken för dynamisk MRD-övervakning av kolorektal cancer når miljontals människor varje år.
Det kan konstateras att forskningsresultaten har viktig vetenskaplig och praktisk betydelse. Genom storskaliga prospektiva kliniska studier har det bekräftats att PCR-baserad blod-ctDNA-multigenmetyleringsteknik kan användas för att förutsäga och övervaka återfall i kolorektal cancer med både känslighet, aktualitet och kostnadseffektivitet, vilket gör det möjligt för precisionsmedicin att gynna fler cancerpatienter. Studien är baserad på ColonAiQ®, ett multigenmetyleringstest för kolorektal cancer utvecklat av KUNY, vars kliniska tillämpningsvärde vid tidig screening och diagnos har bekräftats av en central klinisk studie.
Gastroenterology (IF33.88), den ledande internationella tidskriften inom mag-tarmsjukdomar år 2021, rapporterade multicenterforskningsresultat från Zhongshan Hospital vid Fudan University, Cancer Hospital vid Fudan University och andra auktoritativa medicinska institutioner i samarbete med KUNYAN Biological, vilket bekräftade ColonAiQ® ChangAiQ®s utmärkta prestanda vid tidig screening och tidig diagnos av kolorektal cancer, och undersökte inledningsvis även den potentiella tillämpningen vid prognosövervakning av kolorektal cancer.
För att ytterligare validera den kliniska tillämpningen av ctDNA-metylering vid riskstratifiering, vägledning av behandlingsbeslut och tidig återfallsövervakning vid kolorektal cancer i stadium I-III, inkluderade forskargruppen 299 patienter med kolorektal cancer i stadium I-III som genomgick radikal kirurgi och samlade in blodprover vid varje uppföljningstillfälle (med tre månaders mellanrum) inom en vecka före operationen, en månad efter operationen och i postoperativ adjuvant behandling för dynamisk ctDNA-testning i blodet.
Först fann man att ctDNA-testning kunde förutsäga risken för återfall hos patienter med kolorektal cancer tidigt, både preoperativt och tidigt postoperativt. Preoperativt ctDNA-positiva patienter hade en högre sannolikhet för postoperativt återfall än preoperativt ctDNA-negativa patienter (22,0 % > 4,7 %). Tidig postoperativ ctDNA-testning förutspådde fortfarande risken för återfall: en månad efter radikal resektion var ctDNA-positiva patienter 17,5 gånger mer benägna att få återfall än negativa patienter; teamet fann också att kombinerad ctDNA- och CEA-testning förbättrade prestandan något för att detektera återfall (AUC=0,849), men skillnaden var inte signifikant jämfört med enbart ctDNA-testning (AUC=0,839). Skillnaden var inte signifikant jämfört med enbart ctDNA (AUC=0,839).
Klinisk stadieindelning i kombination med riskfaktorer är för närvarande den huvudsakliga grunden för riskstratifiering av cancerpatienter, och i det nuvarande paradigmet får ett stort antal patienter fortfarande återfall [4], och det finns ett akut behov av bättre stratifieringsverktyg eftersom överbehandling och underbehandling samexisterar i kliniken. Baserat på detta klassificerade teamet patienter med stadium III kolorektal cancer i olika undergrupper baserat på klinisk bedömning av återfallsrisk (hög risk (T4/N2) och låg risk (T1-3N1)) och adjuvant behandlingsperiod (3/6 månader). Analysen fann att patienter i högriskgruppen av ctDNA-positiva patienter hade en lägre återfallsfrekvens om de fick sex månaders adjuvant behandling; i lågriskgruppen av ctDNA-positiva patienter fanns det ingen signifikant skillnad mellan den adjuvanta behandlingscykeln och patientresultaten; medan ctDNA-negativa patienter hade en signifikant bättre prognos än ctDNA-positiva patienter och en längre postoperativ återfallsfri period (RFS); stadium I och lågrisk stadium II kolorektal cancer. Alla ctDNA-negativa patienter hade inget återfall inom två år; Därför förväntas integrationen av ctDNA med kliniska egenskaper ytterligare optimera riskstratifieringen och bättre förutsäga återfall.
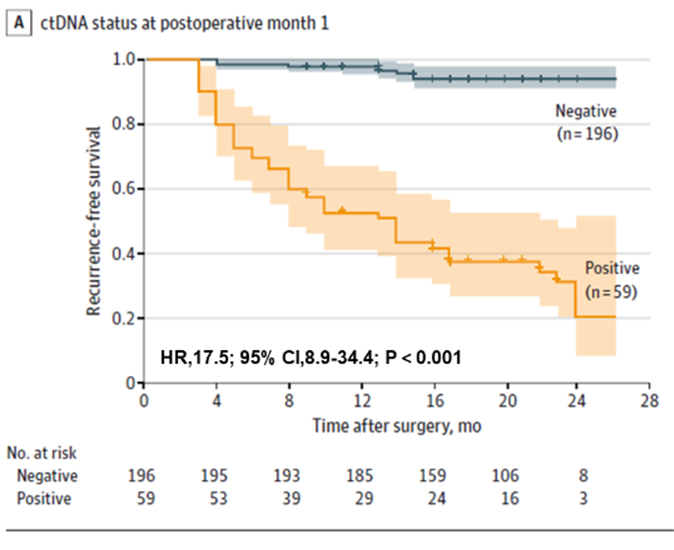
Figur 1. Plasma-ctDNA-analys vid POM1 för tidig upptäckt av återfall av kolorektal cancer
Ytterligare resultat av dynamisk ctDNA-testning visade att risken för återfall var signifikant högre hos patienter med positiv dynamisk ctDNA-testning än hos patienter med negativ ctDNA under övervakningsfasen av sjukdomsåterfall efter definitiv behandling (efter radikal kirurgi + adjuvant behandling) (Figur 3ACD), och att ctDNA kan indikera tumöråterfall upp till 20 månader tidigare än bilddiagnostik (Figur 3B), vilket ger möjlighet till tidig upptäckt av sjukdomsåterfall och snabb intervention.
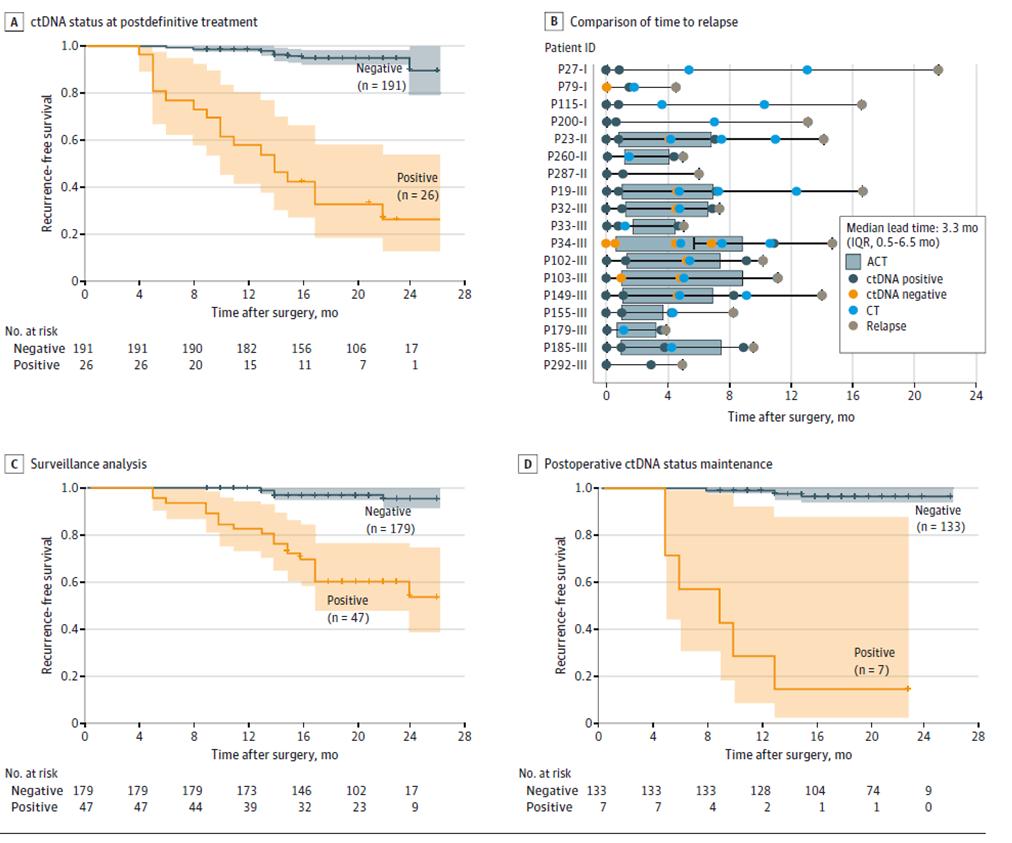
Figur 2. ctDNA-analys baserad på longitudinell kohort för att detektera återfall av kolorektal cancer
”Ett stort antal translationella medicinska studier av kolorektal cancer leder disciplinen, särskilt ctDNA-baserad MRD-testning visar stor potential att förbättra postoperativ behandling av patienter med kolorektal cancer genom att möjliggöra stratifiering av återfallsrisk, vägleda behandlingsbeslut och tidig övervakning av återfall.”
Fördelen med att välja DNA-metylering som en ny MRD-markör jämfört med mutationsdetektion är att den inte kräver helgenomsekvenseringsscreening av tumörvävnader, används direkt för blodprov och undviker falskt positiva resultat på grund av detektion av somatiska mutationer som härrör från normala vävnader, godartade sjukdomar och klonal hematopoes.
Denna studie och andra relaterade studier bekräftar att ctDNA-baserad MRD-testning är den viktigaste oberoende riskfaktorn för återfall av stadium I-III kolorektal cancer och kan användas för att vägleda behandlingsbeslut, inklusive "eskalering" och "nedgradering" av adjuvant behandling. MRD är den viktigaste oberoende riskfaktorn för återfall efter operation för kolorektal cancer i stadium I-III.
Området MRD utvecklas snabbt med ett antal innovativa, mycket känsliga och specifika analyser baserade på epigenetik (DNA-metylering och fragmentomik) och genomik (ultradjup riktad sekvensering eller helgenomsekvensering). Vi förväntar oss att ColonAiQ® fortsätter att organisera storskaliga kliniska studier och kan bli en ny indikator för MRD-testning som kombinerar tillgänglighet, hög prestanda och överkomliga priser och kan användas i stor utsträckning i rutinmässig klinisk praxis.
Referenser
[1] Mo S, Ye L, Wang D, Han L, Zhou S, Wang H, Dai W, Wang Y, Luo W, Wang R, Xu Y, Cai S, Liu R, Wang Z, Cai G. Tidig upptäckt av molekylär kvarvarande sjukdom och riskstratifiering för stadium I till III kolorektal cancer via cirkulerande tumör-DNA-metylering. JAMA Oncol. 20 april 2023.
[2] ”Bördan av kolorektal cancer i den kinesiska befolkningen: har den förändrats under senare år?”, Chinese Journal of Epidemiology, vol. 41, nr 10, oktober 2020.
[3] Tarazona N, Gimeno-Valiente F, Gambardella V, et al. Riktad nästa generations sekvensering av cirkulerande tumör-DNA för att spåra minimal kvarvarande sjukdom vid lokaliserad koloncancer. Ann Oncol. 1 november 2019;30(11):1804-1812.
[4] Taieb J, André T, Auclin E. Förfining av adjuvant behandling för icke-metastaserande koloncancer, nya standarder och perspektiv. Cancer Treat Rev. 2019;75:1-11.
Publiceringstid: 28 april 2023
 中文网站
中文网站